药品信息
2022年湖北省药品技术审评分析报告
来源:火狐直播平台 作者:火狐直播平台下载 日期:2024-05-17 07:20:32
说明:本报告所用数据来源于湖北省药品监督管理局审评中心技术审查远程监控及工作平台和国家药品监督管理局数据查询平台,数据报告期为
据数据统计,2022年全国各省份及直辖市(除港澳台外)共公示境内生产药品备案23163件,排名前五的省份是江苏、广东、吉林、广西、浙江。湖北省生产药品备案数为860件,占全国生产药品备案数量的3.71%,排名全国第十,华中地区排名第一,具体数据详见图1。

2022年我省出台《湖北省原料药生产基地建设实施方案(2021—2025年)》,快速推进湖北省原料药及小品种药(短缺药)生产基地建设,发挥我省原料药及小品种药产业优势,促进原料药及小品种药发展,增强保障供应能力。
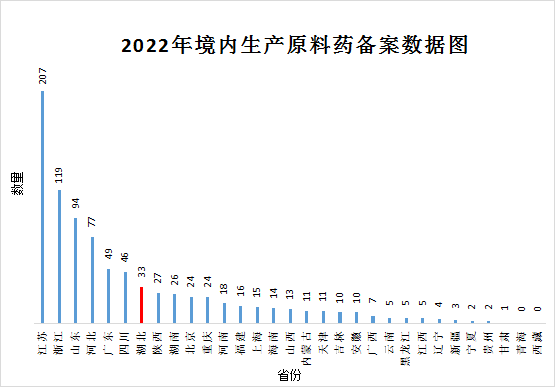
据数据统计,2022年全国原料药公示备案共有878项,其中湖北省共有原料药公示备案33项,占全国原料药备案数量的3.76%,在全国排名第七,华中地区排名第一,具体数据详见图2。
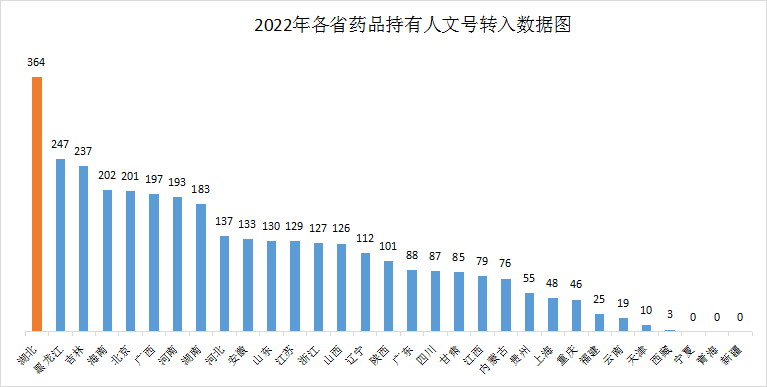
根据国家药审中心发布的全国药品上市许可持有人变更申请数据统计,截至2022年11月,湖北省共转入364个品种,转入量达到全国第一,具体数据详见图3。分析原因,我省近年品种转入量高的问题大多有以下几点:
(一)优化原辅料变更程序。因长期未生产对变更前原辅料无法开展质量对比,可购买市售产品做对比研究。
(三)提前介入工艺变更。“店小二”服务团进行专人对接跟踪指导,加快企业申报进度。
(四)多渠道开展工艺核对。按照真实的情况通过多渠道、多方法加快对企业原始工艺的认定。
(五)委省政府全力支持生物医药产业高水平质量的发展。出台多条激励政策吸引市场主体扩大投入,将更多的药品文号引入湖北,促进我省医药市场的蓬勃发展。
审评中心2022年共接收药品中等变更备案655项,平均每月办件55件,较2021年增加19件,平均每月办件量增长52.78%。
其中,接收化学药品中等变更备案387项,占全年接收量的59.08%,较2021年的279项增长38.71%;接收中药中等变更备案240项,占全年接收量的36.64%,较2021年的114项增长110.53%;接收生物制品28项,较2021年的38项降低26.32%,根本原因为2021年武汉生物增线扩产过程中的相关变更备案已办结,具体数据详见图4。

截止2022年底,全省共有118个批准文号获得仿制药质量和疗效一致性评价(以下简称“一致性评价”),其中2022年获批13个品种。
审评中心2022年共接收106项通过一致性评价品种的中等变更备案事项,涉及的变更类别主要是变更有效期和贮藏条件、变更说明书和标签、变更原料药供应商、变更制剂生产的基本工艺、变更生产批量、变更包装材料和容器等,各变更类别对应的具体数据详见图5。

结合以上数据分析,在2022年接收的通过一致性评价品种的中等变更备案事项中,变更有效期和贮藏条件达到第一,这是因为企业通常在过评阶段的稳定性研究数据较少,往往在获批后对药品的稳定性进行持续的考察,积累数据后在省内进行变更备案,以期延长效期;变更原辅包供应商办件量较多,根本原因为目前各企业均在进行国产物料可替代化研究,增加原料药供应商也是出于控制成本和市场可及性的考虑。
(1)企业自评估为微小变更的共有30项,经过沟通交流后,8项变更等级上升,其中3项定为重大变更,5项定为中等变更;4项由于缺乏详细的资料佐证最终定义为没办法判定;1项由于资料不充分企业选择退审;剩余17项符合企业自评估的微小变更。
(2)企业自评估为中等变更的共有41项,经过沟通交流后,6项等级上升为重大变更;30项符合企业自评估的中等变更;2项等级下降为微小变更;1项由于缺乏详细的资料佐证最终定义为没办法判定;2项由于资料不充分或者是重复申报企业选择退审。
(3)企业自评估为重大变更的有1项,经过沟通交流后,此项目符合企业自评估的重大变更。
(4)企业变更类别较多申报组合变更的有2项,经沟通交流后,1项定为重大变更,1项由于企业缺乏详细的资料佐证暂时没办法判定变更类别。
(5)企业对自身变更类别没办法判定,请求沟通交流的共有8项,经沟通后,其中2项定为重大变更,2项定为中等变更,1项为微小变更,1项为企业重复申报选择退审,2项由于企业申报缺乏详细的资料佐证暂时没办法判定变更类别。
综上所述,在沟通交流后,确定为重大变更的事项共有13项,占总数的15.85%,沟通交流机制的贯彻执行优化了审评员与企业间的沟通渠道,提高了审评效能,节省了企业办件时限。
通过以上数据分析,对我省2022年的中等变更备案以及沟通交流情况做了归纳汇总,同时也为2023年审评中心工作的开展提供了目标和建议:
(一)畅通沟通渠道,优化“店小二”服务。在企业申报业务时,对重点难点项目提前介入服务,与企业多渠道沟通交流,将审评过程中存在的问题说清楚讲明白,跟踪该类问题的后续研究情况,进一步做好“店小二”服务,以此鼓励企业创新。
(二)加强队伍建设,提升审评能力。建立专家型、多层次、立体式的审评员管理体系,拓宽学习渠道,夯实队伍建设。一是积极向上去CDE学习,把控了解CDE的审评尺度,不断学习提升;二是学习先进省份的经验,借鉴他们在审评时的优秀经验;三是在工作条件允许的情况下,增加向药品生产企业和药检院学习机会,在生产、检验一线夯实基础,帮助审评员提高个人的能力,扩充知识面。
(三)优化工作程序,提升工作效率。建议加强完善现场检查及抽样工作程序,明确需进行现场检查及抽样的中等变更事项。对通过一致性评价的品种相关变更事项是否需开展专家审评、检查或抽样进行明确。
| ©火狐直播_赛事|官方下载|平台官网 苏ICP备10215542号-1 (苏)-非经营性-2014-0026 |
